Chiết xuất bồ công anh ức chế sự phát triển của tế bào ung thư vú ba âm tính bằng cách can thiệp vào quá trình chuyển hóa glycerophospholipid và axit béo không bão hòa
1. Tóm tắt
Ung thư vú ba âm tính (TNBC) là phân nhóm ung thư vú hung hãn nhất với các lựa chọn điều trị hạn chế và tiên lượng xấu. TNBC tồn tại chuyển hóa lipid được lập trình lại rộng rãi và các protein liên quan đến chuyển hóa và các chất chuyển hóa gây ung thư của nó hứa hẹn là các mục tiêu điều trị tiềm năng. Bồ công anh ( Taraxacum mongolicum ) là một loại thuốc thảo dược cổ điển được sử dụng để điều trị các bệnh về vú dựa trên lý thuyết y học cổ truyền Trung Quốc và được báo cáo là có tác dụng chống khối u và khả năng điều hòa lipid. Nghiên cứu trước đây của chúng tôi cho thấy chiết xuất bồ công anh có hiệu quả chống lại TNBC. Tuy nhiên, liệu chiết xuất bồ công anh có thể điều chỉnh chuyển hóa lipid của TNBC và phát huy tác dụng chống khối u của nó thông qua việc can thiệp vào quá trình chuyển hóa lipid hay không vẫn chưa rõ ràng. Trong nghiên cứu này, một phương pháp tiếp cận tích hợp kết hợp với dược lý học mạng lưới và các kỹ thuật đa ô-míc (bao gồm nghiên cứu về protein, nghiên cứu về chuyển hóa và nghiên cứu về lipid) đã được thực hiện để nghiên cứu các cơ chế điều hòa tiềm ẩn của chiết xuất bồ công anh đối với TNBC. Đầu tiên, chúng tôi xác định tác dụng chống khối u của chiết xuất bồ công anh trong ống nghiệm và trong cơ thể sống . Sau đó, phân tích dược lý mạng lưới suy đoán các tác dụng chống khối u liên quan đến nhiều quá trình trao đổi chất khác nhau và kết quả đa ô-míc của các tế bào, mô khối u và huyết tương cho thấy những thay đổi trong các chất chuyển hóa và protein liên quan đến trao đổi chất sau khi điều trị bằng chiết xuất bồ công anh. Sự thay đổi của glycerophospholipid và axit béo không bão hòa là những loại chất chuyển hóa đáng chú ý nhất. Do đó, quá trình trao đổi chất của glycerophospholipid và axit béo không bão hòa, và các protein tương ứng của chúng là CHKA và FADS2, được coi là các con đường điều hòa chính và các dấu ấn sinh học của chiết xuất bồ công anh chống lại TNBC. Sau đó, xác nhận thực nghiệm cho thấy chiết xuất bồ công anh làm giảm biểu hiện CHKA, dẫn đến ức chế con đường PI3K/AKT và các mục tiêu hạ lưu của nó, SREBP và FADS2. Cuối cùng, mô phỏng ghép nối phân tử cho thấy picrasinoside F và luteolin trong chiết xuất bồ công anh có điểm liên kết cao nhất với CHKA, cho thấy chúng có thể là chất ức chế CHKA tiềm năng để điều hòa quá trình trao đổi chất glycerophospholipid của TNBC. Tóm lại, chúng tôi đã xác nhận tác dụng chống khối u của chiết xuất bồ công anh đối với tế bào TNBC trong ống nghiệm và chứng minh rằng chiết xuất bồ công anh có thể can thiệp vào quá trình chuyển hóa glycerophospholipid và axit béo không bão hòa thông qua việc điều hòa giảm biểu hiện CHKA và ức chế trục PI3K/AKT/SREBP/FADS2.
2. Giới thiệu
Ung thư vú đã vượt qua ung thư phổi để trở thành loại ung thư được chẩn đoán phổ biến nhất trên toàn thế giới với tỷ lệ mắc và tử vong cao theo dữ liệu ung thư toàn cầu mới nhất năm 2020 của Cơ quan Nghiên cứu Ung thư Quốc tế. Khoảng 15%–20% ung thư vú nguyên phát là ung thư vú ba âm tính (TNBC), đặc trưng bởi sự vắng mặt của thụ thể estrogen (ER), thụ thể progesterone và thụ thể yếu tố tăng trưởng biểu bì ở người-2. TNBC có các đặc điểm lâm sàng cụ thể với khả năng xâm lấn cao, khả năng di căn cao, dễ tái phát và tiên lượng xấu. Do tính không đồng nhất về mặt phân tử và lâm sàng, TNBC không có thuốc nhắm mục tiêu và chiến lược điều trị có hiệu quả cao. Do đó, việc khám phá ra các dấu ấn sinh học mới đặc hiệu và khai thác các loại thuốc thay thế mới và hiệu quả để điều trị TNBC là điều cần thiết và cấp bách.
Chuyển hóa mất điều hòa thường tồn tại trong các bệnh ung thư ác tính nguyên phát và một số con đường chuyển hóa là cơ sở cho sự khởi phát và tiến triển của ung thư. Ung thư vú có tính không đồng nhất về chuyển hóa và các kiểu chuyển hóa được lập trình lại của nó khác nhau giữa các phân nhóm TNBC và ER + . Đáng chú ý, TNBC cũng có tính không đồng nhất về chuyển hóa vốn có và một nghiên cứu lâm sàng cho thấy 60% mẫu khối u TNBC tồn tại các con đường chuyển hóa lipid được điều hòa tăng đáng kể. Chuyển hóa lipid bất thường ở TNBC có thể cung cấp các phân tử sinh học như axit béo không bão hòa để tổng hợp phospholipid và hình thành màng tế bào và tạo ra năng lượng, thúc đẩy và duy trì sự tiến triển và tồn tại của TNBC một cách hiệp đồng. Đồng thời, nhiều enzyme và chất chuyển hóa liên quan đến chuyển hóa lipid đã thay đổi đáng kể ở TNBC. Ví dụ, protein liên kết với yếu tố điều hòa sterol (SREBP), một phân tử điều hòa quan trọng trong quá trình chuyển hóa lipid và synthase axit béo (FASN) hạ lưu của nó, fat acid desaturase 2 (FADS2) đã tăng đáng kể trong các mô TNBC. So với tình trạng sức khỏe, phân tích lipid trong máu ngoại vi ở bệnh nhân TNBC cho thấy những rối loạn chuyển hóa nổi bật ở choline, sphingolipid và glycerophospholipid. Trong số đó, nồng độ triglyceride và lysophosphatidylcholine (LPC) bị giảm đáng kể. Các protein và chất chuyển hóa liên quan đến chuyển hóa đã thay đổi phản ánh những điểm yếu về chuyển hóa của TNBC. Do đó, chúng có thể được coi là những dấu ấn sinh học đầy hứa hẹn để khám phá và phát triển các mục tiêu điều trị mới và các phương pháp điều trị thay thế hiệu quả.
Các sản phẩm tự nhiên và các dẫn xuất của chúng là nguồn quan trọng để khám phá ra các hợp chất phân tử nhỏ mới để điều trị ung thư. Bồ công anh, được gọi là Taraxacum mongolicum , đã được sử dụng như một loại thuốc thảo dược cổ điển dựa trên lý thuyết y học cổ truyền Trung Quốc trong điều trị các bệnh về vú, bao gồm áp xe vú và tăng sản tuyến vú. Bằng chứng đáng kể chỉ ra rằng bồ công anh và các thành phần của nó có tác dụng ức chế đáng kể đối với nhiều loại tế bào khối u và tác động điều hòa lipid lên tế bào bình thường và mô hình động vật béo, có liên quan chặt chẽ đến việc kích hoạt con đường protein kinase hoạt hóa AMP (AMPK). Ví dụ, chiết xuất bồ công anh làm giảm đáng kể quá trình hình thành mô mỡ và tích tụ lipid ở 3T3-L1, cũng như làm giảm nồng độ cholesterol và triglyceride trong huyết thanh và tích tụ lipid gan ở thỏ ăn nhiều chất béo và chuột. Một nghiên cứu gần đây đã phát hiện ra cơ chế của chiết xuất bồ công anh dạng nước chống lại TNBC thông qua việc điều chỉnh một loạt các quá trình sinh học liên quan đến chu kỳ tế bào và quá trình trao đổi chất. Các nghiên cứu trước đây của chúng tôi đã chỉ ra rằng chiết xuất bồ công anh có thể làm giảm sự phát triển của tế bào TNBC thông qua việc gây ra chứng apoptosis liên quan đến căng thẳng lưới nội chất và ức chế kiểu hình ác tính của tế bào TNBC trong môi trường vi mô liên quan đến đại thực bào khối u. Tuy nhiên, liệu chiết xuất bồ công anh có thể điều chỉnh quá trình chuyển hóa lipid của TNBC và phát huy tác dụng chống khối u thông qua việc can thiệp vào quá trình chuyển hóa lipid hay không vẫn chưa rõ ràng và cần phải làm sáng tỏ.
Dược lý học mạng là một phương pháp tiếp cận đa ngành kết hợp sinh học tính toán, phân tích mạng và xác minh thực nghiệm. Đây là một phương pháp tiếp cận đầy hứa hẹn để khám phá các cơ chế cơ bản giữa thuốc nhiều thành phần như chiết xuất thảo dược và các mục tiêu giả định của chúng). Bên cạnh đó, các kỹ thuật đa ô-míc, bao gồm genomics, transcriptomics, proteomics và metabolomics, có thể phản ánh trực tiếp những thay đổi sau khi điều trị bằng thuốc và đã trở thành công cụ hiệu quả để khám phá các mục tiêu tiềm năng của các sản phẩm tự nhiên hoặc TCM. Do đó, trong nghiên cứu hiện tại, chúng tôi lần đầu tiên chứng minh tác dụng chống khối u của chiết xuất bồ công anh đối với TNBC trong ống nghiệm và trong cơ thể sống . Sau đó, chúng tôi đã tiến hành phân tích tích hợp kết hợp với phân tích dược lý mạng, các kỹ thuật đa ô-míc (proteomics định lượng, metabolomics không nhắm mục tiêu và lipidomics không nhắm mục tiêu), xác nhận thực nghiệm và ghép nối phân tử để nghiên cứu các cơ chế điều hòa tiềm năng của chiết xuất bồ công anh chống lại TNBC in silico và in vitro và sàng lọc các thành phần hoạt tính sinh học chính trong chiết xuất bồ công anh. Sơ đồ nghiên cứu được thể hiện trong Hình 1 .
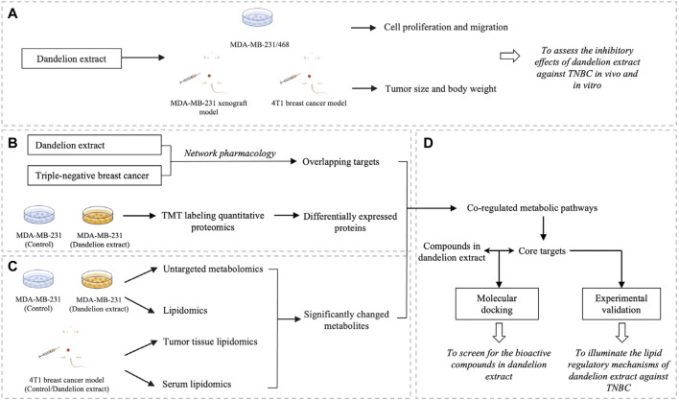
Sơ đồ dòng chảy của phân tích tích hợp cho chiết xuất bồ công anh chống lại TNBC. (A) Tác dụng ức chế của chiết xuất bồ công anh chống lại TNBC trong cơ thể sống và trong ống nghiệm . (B) Phân tích dược lý học mạng và phân tích định lượng protein. (C) Phân tích chuyển hóa và lipidomics sử dụng mẫu tế bào TNBC, mô khối u và huyết tương. (D) Xác minh thực nghiệm các mục tiêu chính và sàng lọc hợp chất hoạt tính sinh học trong chiết xuất bồ công anh thông qua ghép nối phân tử.
3. Vật liệu và phương pháp
Vật liệu và thuốc thử
Huyết thanh thai bò (FBS), dung dịch đệm phosphat (PBS, pH 7,2), trypsin và Dulbecco’s Modified Eagle Medium (DMEM) được mua từ Gibco (Grand Island, NY, Hoa Kỳ). 3-(4,5-dimethyl thiazol-2-yl-)-2, 5-diphenyl tetrazolium bromide (MTT) và dimethyl sulfoxide (DMSO) được mua từ Sigma-Aldrich (St. Louis, MO, Hoa Kỳ). Choline và phosphorylcholine được mua từ TOP SCIENCE (Thượng Hải, Trung Quốc).
Nuôi cấy tế bào
Dòng tế bào TNBC MDA-MB-231 và MDA-MB-468 và tế bào biểu mô vú bình thường của người MCF-10A được lấy từ Ngân hàng tế bào của Cao đẳng Y khoa Liên hiệp Bắc Kinh (Bắc Kinh, Trung Quốc). MDA-MB-231 và MDA-MB-468 được nuôi cấy trong DMEM bổ sung 10% FBS, penicillin (100 đơn vị/mL) và streptomycin (100 μg/ml). Tất cả các tế bào được nuôi trong tủ ấm CO2 5% ở 37°C. MCF-10A được nuôi cấy trong môi trường chuyên dụng (Procell, CM-0525, Trung Quốc) với 5% độc tố tả (Macgene, CC104, Trung Quốc).
Chuẩn bị chiết xuất bồ công anh
Cây bồ công anh được sử dụng trong nghiên cứu này được xác định là Taraxacum mongolicum Hand. Mazz, và chiết xuất của nó được tạo ra như báo cáo trước đó. Tóm lại, toàn bộ cây bồ công anh khô được chiết xuất bằng etanol 50% ba lần, cô đặc trong chân không, sau đó tinh chế bằng sắc ký cột nhựa xốp lớn. Chất rửa giải nước được loại bỏ và phần chất rửa giải etanol 30% được thu thập, bốc hơi và phun cho đến khô. Trong các thí nghiệm trên tế bào, chiết xuất bồ công anh được hòa tan trong DMSO 50% để chuẩn bị dung dịch gốc và pha loãng với môi trường nuôi cấy. Nồng độ cuối cùng của DMSO là 0,5%. Kết quả phân tích MS/MS UHPLC-ESI-Orbitrap cho thấy 20 hợp chất đã được xác định trong chiết xuất bồ công anh và hầu hết trong số chúng là flavonoid và axit phenolic.
Chuyển gen siRNA CHKA
Các tế bào MDA-MB-231 với mật độ 1,5×10 5 được chuyển gen với CHKA siRNA (5′- CAUGCUGUUCCAGUGCUCC-3′) (RiboBio Co., Ltd. Quảng Châu, Trung Quốc) bằng cách sử dụng Lipofectamine 2000. SiRNA xáo trộn được sử dụng làm đối chứng âm tính. Nồng độ cuối cùng của CHKAsiRNA và siRNA xáo trộn là 50 nM. Các tế bào được chuyển gen với siRNA xáo trộn hoặc CHKA siRNA được nuôi cấy trong 24 giờ và sau đó đánh giá bằng cách sử dụng phương pháp Western blotting.
Xét nghiệm MTT
Thử nghiệm MTT được thực hiện để đo khả năng sống của tế bào. Tóm lại, các tế bào MCF-10A, MDA-MB-231 và MDA-MB-468 được mạ trong các đĩa 96 giếng (7×10 3 tế bào/giếng) và nuôi cấy qua đêm, sau đó xử lý bằng chiết xuất bồ công anh (0, 10, 20, 40, 80 và 160 μg/ml) trong DMEM với 1% FBS trong 24 giờ. Sau khi rửa bằng 1×PBS, các tế bào được ủ với dung dịch MTT 0,5 mg/ml (100 μl mỗi giếng) ở 37°C trong 4 giờ. Sau đó, loại bỏ phần dịch trong và thêm 100 μl DMSO để hòa tan các tinh thể formazan. Mật độ quang học được xác định ở 570 nm bằng Tecan Infinite 200 pro. Dữ liệu được phân tích và trực quan hóa bằng GraphPad Prism 9.0.
Xét nghiệm chữa lành vết thương
Sự di chuyển tế bào được thực hiện bằng cách sử dụng xét nghiệm chữa lành vết thương. Các tế bào MDA-MB-231 và MDA-MB-468 được mạ trong các đĩa 6 giếng ở 4 × 105 tế bào mỗi giếng và được ủ để phát triển để đạt được sự hợp lưu 90%. Sau đó, các đầu pipet màu vàng được sử dụng để tạo các vết xước tuyến tính và các mảnh vụn tế bào được loại bỏ bằng cách rửa bằng 1×PBS. Sau đó, các tế bào được nuôi cấy trong DMEM với 1% FBS và được xử lý bằng chiết xuất bồ công anh ở các nồng độ khác nhau (0, 10, 20, 40, 80 và 160 μg/ml). Các hình ảnh được chụp bằng kính hiển vi đảo ngược Leica DMi8. Chiều rộng vết xước được đo bằng phần mềm ImageJ và tốc độ đóng vết thương được tính toán và phân tích bằng GraphPad Prism 9.0.
Xây dựng mô hình động vật
Để đánh giá tác dụng chống khối u của chiết xuất bồ công anh trong cơ thể sống , chúng tôi đã xây dựng mô hình ghép dị chủ MDA-MB-231 và mô hình ung thư vú 4T1 sử dụng chuột NOG và chuột BALB/C. Chuột NOG cái và chuột BALB/C (6–8 tuần tuổi) được mua từ Công ty TNHH Khoa học sinh học HFK Bắc Kinh (Bắc Kinh, Trung Quốc) và được nuôi trong môi trường không có mầm bệnh cụ thể với chu kỳ sáng/tối 12 giờ và đủ thức ăn và nước uống. Tất cả các quy trình liên quan đến chuột đều tuân theo hướng dẫn về đạo đức động vật và được Ủy ban nghiên cứu động vật của Đại học Bắc Kinh chấp thuận. Tóm lại, sau 1 tuần thích nghi, 2,5 × 106 tế bào MDA-MB-231 (được tái huyền phù trong 100 μl Matrigel cho chuột NOG) và 2 × 104 tế bào 4T1 (được tái huyền phù trong 100 μl PBS cho chuột BALB/C) được cấy ghép vào tuyến vú bẹn thứ tư. Khi khối u có thể sờ thấy, những con chuột được chia ngẫu nhiên thành ba nhóm (n = 6 trong mô hình ghép dị chủ MDA-MB-231 trên mỗi nhóm, n = 8 trong mô hình 4T1 trên mỗi nhóm), bao gồm nhóm đối chứng (tiêm phúc mạc bằng 0,1% natri carboxymethylcellulose) và nhóm chiết xuất bồ công anh (tiêm phúc mạc bằng 50 và 100 mg/kg chiết xuất bồ công anh hòa tan 0,1% natri carboxymethylcellulose). Thể tích khối u được đo sau mỗi 2–3 ngày và được tính theo công thức sau: thể tích khối u (mm3) = 0,5 × d1 × d22, trong đó d1 là đường kính dài nhất và d2 là đường kính ngắn nhất. Vào thời điểm cuối của các thí nghiệm trên động vật ( tùy thuộc vào kích thước khối u), các khối u đã cắt bỏ được cân và huyết tương được thu hoạch.
Phân tích dược lý mạng
Các thành phần hóa học từ chiết xuất bồ công anh đã được xác định bằng phương pháp sắc ký lỏng khối phổ trong nghiên cứu trước đây của chúng tôi. Cấu trúc hóa học và SMILES ID của chúng được lấy từ cơ sở dữ liệu PubChem. Các mục tiêu giả định tương ứng của các thành phần hóa học được dự đoán bởi ba cơ sở dữ liệu khác nhau, bao gồm SwissTargetPrediction, SEA và PharmMapper. Các mục tiêu liên quan đến TNBC được thu thập từ cơ sở dữ liệu DisGeNET và GeneCards với từ khóa “ung thư vú ba âm tính”. Để đánh giá độ tin cậy của phương pháp, chúng tôi đã xác nhận độ chính xác của các mục tiêu dự đoán dựa trên việc thu hồi thông qua các phương tiện khai thác tài liệu. Tỷ lệ chính xác được tính bằng (số giao điểm của các mục tiêu dự đoán và các phân tử sinh học được báo cáo) / (số mục tiêu dự đoán) × 100%. Các gen chồng chéo giữa các thành phần hóa học của chiết xuất bồ công anh và TNBC được ảo hóa bằng biểu đồ Venn. Đáng chú ý, chỉ có gen của con người được giữ lại. Mạng lưới “mục tiêu bệnh phức hợp” và phân tích cấu trúc của nó được thực hiện thông qua phần mềm Cytoscape (phiên bản 3.6.1). Làm giàu chức năng Gene Ontology (GO) và làm giàu con đường Kyoto Encyclopedia of Genes and Genomes (KEGG) được thực hiện bằng cách sử dụng cơ sở dữ liệu DAVID. Kết quả của họ được trực quan hóa bằng gói ggplots trong phần mềm R.
Phân tích đa omics
Trong nghiên cứu này, chúng tôi đã thực hiện phân tích định lượng proteomics, metabolomics không nhắm mục tiêu và lipidomic không nhắm mục tiêu trên các mẫu tế bào để phát hiện các lỗ hổng chuyển hóa của TNBC sau khi điều trị bằng chiết xuất bồ công anh. Ba lô mẫu tế bào MDA-MB-231 với xử lý bằng nhau đã được sử dụng để phân tích đa omics. Và mô khối u và huyết tương từ mô hình chuột 4T1 đã được sử dụng cho lipidomics. Tóm lại, các tế bào MDA-MB-231 được chia thành hai nhóm được xử lý bằng chất mang (50% DMSO) hoặc chiết xuất bồ công anh (40 μg/ml) với nồng độ dưới ngưỡng gây chết (40 μg/ml) dựa trên giá trị IC50 của nó. Các tế bào được nuôi cấy trong DMEM bổ sung 1% FBS (ba lần cho mỗi nhóm) trong 24 giờ. Sau đó, các mẫu tế bào được rửa bằng 1×PBS và thu thập vào các ống ly tâm khác nhau để phân tích LC-MS/MS. Các protein biểu hiện khác biệt được thu được bằng phương pháp định lượng proteomics gắn nhãn Tandem Mass Tag (TMT) thông qua HPLC-MS/MS. Và các chất chuyển hóa thay đổi đáng kể được xác định bằng phương pháp chuyển hóa không nhắm mục tiêu và lipidomic thông qua UPLC-MS/MS. Các điều kiện và quy trình cụ thể của đa omics được trình bày trong Tài liệu bổ sung .
Phản ứng chuỗi polymerase định lượng thời gian thực
Tổng RNA được chiết xuất từ tế bào bằng thuốc thử Trizol (Invitrogen, Hoa Kỳ) và nồng độ của nó được đo thông qua NanoDrop 2000 (Thermo, Hoa Kỳ). cDNA được tổng hợp bằng Bộ tổng hợp cDNA Hifair II 1st Strand (Yeasen Biotech, Trung Quốc). qRT-PCR được thực hiện bằng cách sử dụng SYBR Green qPCR Supermix (Applied Biosystems, Hoa Kỳ) trên 7.500 Hệ thống PCR thời gian thực nhanh (Thermo, Hoa Kỳ). Các mồi đến từ Sangon Biotech (Thượng Hải, Trung Quốc) và trình tự của chúng được liệt kê trong Bảng bổ sung S1 . Quy trình qRT-PCR để khuếch đại định lượng là 95°C trong 5 phút, sau đó là 40 chu kỳ trong 15 giây ở 95°C, 20 giây ở 60°C và 40 giây ở 72°C. Dữ liệu được phân tích và trực quan hóa thông qua GraphPad 9.0.
Western blotting
Tiến hành Western blotting để xác nhận kết quả phân tích tích hợp. Tóm lại, nồng độ protein được xác định bằng Bộ dụng cụ BCA (Thermo, Hoa Kỳ). Các mẫu protein (20 μg) được tách bằng SDS-PAGE và chuyển lên màng PVDF (Millipore, Hoa Kỳ). Sau đó, màng được chặn bằng 5% sữa tách béo trong dung dịch TBS bổ sung 0,1% Tween-20 (TBST) trong 1 giờ ở nhiệt độ phòng và sau đó ủ qua đêm ở 4°C với các kháng thể chính đặc hiệu. Sau đó, màng được rửa bằng TBST và ủ với các kháng thể thứ cấp liên hợp với peroxidase cải ngựa ở nhiệt độ phòng trong 1 giờ. Cuối cùng, các dải protein được hình dung bằng bộ dụng cụ thuốc thử phát quang hóa học tăng cường (Millipore, MA). Thông tin cụ thể về các kháng thể được sử dụng trong nghiên cứu này được thể hiện trong Bảng bổ sung S2 . Đo mật độ được định lượng bằng phần mềm ImageJ và chuẩn hóa theo biểu hiện GAPDH.
Phân tích mô hình phân tử
Cấu trúc phân tử của hợp chất được lấy từ cơ sở dữ liệu PubChem, và cấu trúc tinh thể protein của mục tiêu ứng viên được lấy từ cơ sở dữ liệu Ngân hàng dữ liệu protein RCSB (PDB). Các cấu trúc protein được xử lý thông qua AutoDockTools để loại bỏ các phân tử phối tử và nước, tính toán điện tích Gasteiger, thêm hydro phân cực và hợp nhất hydro không phân cực. Các cấu trúc protein và hợp chất đã chuẩn bị được lưu ở định dạng PDBQT. Hộp liên kết được thiết lập để chứa tất cả các cấu trúc protein 3D và các tham số gắn kết khác tuân theo giá trị mặc định trong AutoDock Vina. Tiếp theo, sơ đồ năng lượng thế của cấu trúc và liên kết hydro được hiển thị trong PyMOL.24.
Phân tích thống kê
Dữ liệu được thể hiện dưới dạng giá trị trung bình ± sai số chuẩn (SD) từ ba thí nghiệm độc lập. Đánh giá dữ liệu được thực hiện bằng kiểm định t của Student hai đuôi. p < 0,05 được coi là sự khác biệt có ý nghĩa thống kê.
Kết quả
Chiết xuất bồ công anh ức chế sự tăng sinh và di chuyển của tế bào TNBC trong ống nghiệm và trong cơ thể sống
Trong nghiên cứu này, chúng tôi đã thực hiện thử nghiệm MTT và chữa lành vết thương trên các tế bào MCF-10A, MDA-MB-231 và MDA-MB-468 để đánh giá tác dụng chống khối u của chiết xuất bồ công anh. Như thể hiện trong Hình 2A , khả năng sống của tế bào TNBC giảm theo liều lượng và thời gian sau khi điều trị bằng chiết xuất bồ công anh. Giá trị IC 50 của chiết xuất bồ công anh trên MDA-MB-231 và MDA-MB-468 lần lượt là 110,8 ± 9,2 μg/ml và 107,9 ± 5,6 μg/ml trong 24 giờ. Tuy nhiên, chiết xuất bồ công anh chỉ cho thấy tác dụng ức chế của nó đối với MCF-10A ở nồng độ cao nhất (160 μg/ml) ở thời điểm 48 và 72 giờ. Hơn nữa, khả năng đóng vết thương của tế bào TNBC giảm đáng kể do chiết xuất bồ công anh theo cách phụ thuộc vào liều lượng và thời gian ( Hình 2B ). Những kết quả này cho thấy rằng chiết xuất bồ công anh có thể ức chế sự tăng sinh và di chuyển trong các tế bào TNBC hơn là các tế bào vú bình thường. Để xác định thêm liệu chiết xuất bồ công anh có thể ức chế sự phát triển của khối u trong mô hình ghép dị loại MDA-MB-231 và mô hình chuột 4T1 hay không, chuột được cho dùng chiết xuất bồ công anh (50 và 100 mg/kg) hàng ngày trong 15 và 20 ngày. Chúng tôi thấy rằng chiết xuất bồ công anh có thể làm giảm đáng kể thể tích và trọng lượng khối u theo cách phụ thuộc vào liều lượng trong mô hình ghép dị loại MDA-MB-231 và mô hình chuột 4T1. Đáng chú ý là không có sự khác biệt rõ ràng về trọng lượng cơ thể sau khi điều trị bằng chiết xuất bồ công anh ( Hình 2C, D ). Những kết quả này chỉ ra rằng bồ công anh có tác dụng ức chế mạnh đối với TNBC in vivo và in vitro .
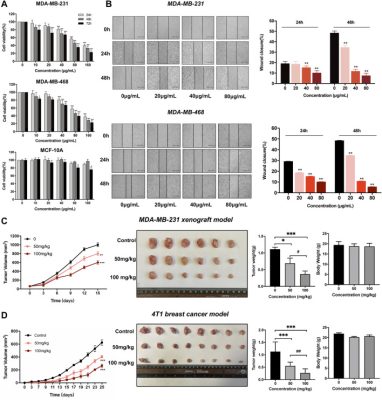
Chiết xuất bồ công anh ức chế sự phát triển khối u và kiểu hình ác tính của tế bào TNBC ở mô hình chuột ung thư vú. (A) Chiết xuất bồ công anh ức chế sự tăng sinh tế bào trên MDA-MB-231, MDA-MB-468 và MCF-10A. *p < 0,05 , **p < 0,01 , ***p < 0,005 so với 24 giờ. (B) Chiết xuất bồ công anh ức chế sự di chuyển của tế bào TNBC theo cách phụ thuộc vào liều lượng. *p < 0,05 , **p < 0,01 , ***p < 0,005 so với 0 μg/ml (C) Chiết xuất bồ công anh làm giảm sự phát triển khối u ở mô hình ghép dị chủ MDA-MB-231. (D) Chiết xuất bồ công anh làm giảm sự phát triển khối u ở mô hình chuột 4T1BALB/C. *p < 0,05 , **p < 0,01 , ***p < 0,001 so với nhóm đối chứng (0 mg/kg), # p < 0,05 , ## p < 0,01 , ### p < 0,001 so với chiết xuất bồ công anh (50 mg/kg).
Dược lý học mạng lưới suy đoán các cơ chế điều hòa có thể có của chiết xuất bồ công anh chống lại TNBC
Dược lý học mạng có thể thể hiện sự phức tạp giữa các hợp chất, bệnh tật và hệ thống sinh học theo quan điểm mạng và do đó dự đoán các cơ chế tương tác của chúng. Do đó, phân tích dược lý học mạng đã được sử dụng để phỏng đoán các cơ chế tiềm ẩn của chiết xuất bồ công anh chống lại TNBC và sàng lọc các hợp chất hoạt tính sinh học chính trong chiết xuất bồ công anh. Các nghiên cứu trước đây của chúng tôi đã xác định được 22 hợp chất hoạt tính sinh học từ chiết xuất bồ công anh thông qua LC-MS, trong đó 17 hợp chất có ID SMILE từ cơ sở dữ liệu PubChem để thực hiện phân tích dược lý học mạng. Cấu trúc hóa học và thông tin chi tiết được thể hiện trong Hình bổ sung S1, S2 và Bảng bổ sung S3 . Cuối cùng, tổng cộng 942 mục tiêu giả định liên quan đến hợp chất và 225 mục tiêu liên quan đến TNBC đã được thu thập sau khi loại bỏ bản sao và 76 mục tiêu chồng chéo đã được hợp nhất ( Hình 3A ). Tất cả các mục tiêu đã được đưa vào cơ sở dữ liệu UniProt để có được các từ đồng nghĩa gen tiêu chuẩn của chúng (Bảng bổ sung S4 ) và tỷ lệ chính xác của các mục tiêu dự đoán là cao.
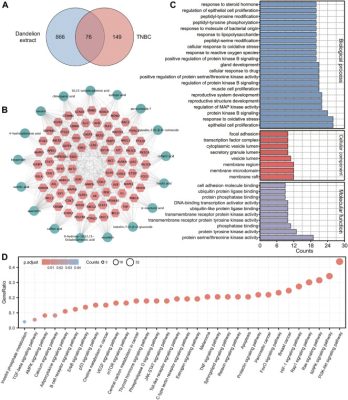
Phân tích dược lý mạng dự đoán các cơ chế điều hòa cơ bản của chiết xuất bồ công anh chống lại TNBC. (A) Biểu đồ Venny của các mục tiêu chồng chéo của chiết xuất bồ công anh và TNBC. (B) Mạng hợp chất-bệnh-mục tiêu. Hình thoi màu hồng chỉ ra các gen chồng chéo và các vòng tròn màu xanh lá cây nhạt chỉ ra các hợp chất trong chiết xuất bồ công anh. (C) Phân tích GO cho các gen chồng chéo. Trục x biểu thị số lượng gen và trục y biểu thị các thuật ngữ được làm giàu. ( p < 0,05 ). (D) Làm giàu con đường KEGG cho các gen chồng chéo. Trục x biểu thị các thuật ngữ được làm giàu và trục y biểu thị tỷ lệ gen ( p < 0,05 ).
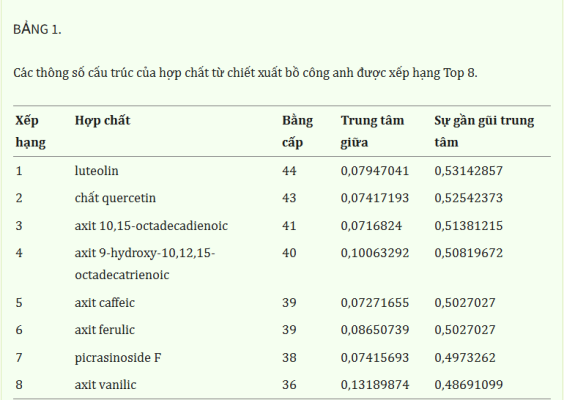
Sau đó, chúng tôi đã xây dựng một mạng lưới “hợp chất-bệnh tật-mục tiêu” bao gồm 11 nút và 22 cạnh và phân tích các tham số tôpô của nó, bao gồm mức độ, độ trung tâm giữa và độ trung tâm gần ( Hình 3B ). Các giá trị tham số có thể phản ánh tầm quan trọng của từng hợp chất trong mạng lưới. Bảng 1 cho thấy tám hợp chất có giá trị tham số lớn hơn giá trị trung bình, như luteolin, quercetin và axit 10,15-octadecadienoic, có thể được coi là các thành phần hoạt tính sinh học chính trong chiết xuất bồ công anh. Thông tin tham số chi tiết được hiển thị trong Bảng bổ sung S5 . Sau đó, phân tích chức năng GO và làm giàu con đường KEGG đã được sử dụng để suy đoán các con đường điều hòa có thể có của chiết xuất bồ công anh chống lại TNBC. Hình 3C cho thấy nhiều thuật ngữ được làm giàu, bao gồm sự tăng sinh tế bào, căng thẳng oxy hóa, miền vi mô màng và hoạt động của protein tyrosine kinase, cho thấy rằng chiết xuất bồ công anh có thể phát huy tác dụng chống TNBC của nó bằng cách tác động vào các quá trình sinh học này. Hơn nữa, như thể hiện trong Hình 3D , nhiều con đường truyền tín hiệu liên quan đến quá trình sinh khối u và tiến triển khối u đã được làm giàu, và con đường truyền tín hiệu PI3K/AKT được xếp hạng đầu tiên, cho thấy rằng nó có thể đóng vai trò quan trọng trong tác dụng ức chế của chiết xuất bồ công anh đối với TNBC. Bên cạnh đó, các con đường liên quan đến chuyển hóa, chẳng hạn như con đường truyền tín hiệu AMPK và quá trình chuyển hóa choline trong ung thư, gợi ý về tác dụng điều hòa lipid có thể có của chiết xuất bồ công anh đối với TNBC. Nhìn chung, dược lý học mạng cung cấp một phân tích dự đoán có hệ thống về các cơ chế điều hòa của chiết xuất bồ công anh đối với TNBC in silico .
Hồ sơ proteome và metabolome của tế bào MDA-MB-231 sau khi xử lý chiết xuất bồ công anh
Để khám phá sâu hơn các cơ chế điều hòa của chiết xuất bồ công anh chống lại TNBC, các nghiên cứu định lượng về protein dựa trên TMT và các nghiên cứu về chuyển hóa không nhắm mục tiêu đã được thực hiện trên các mẫu tế bào. Phân tích thành phần chính không giám sát (PCA) cho thấy sự khác biệt đáng kể giữa hai nhóm ( Hình bổ sung S3A ). Kết quả là, tổng cộng 5.049 protein đã được xác định và 3.932 protein đã được định lượng. Dựa trên tiêu chí sàng lọc là thay đổi gấp >1,2 và giá trị p ( p < 0,05 ) , cuối cùng chúng tôi đã xác định được 144 protein biểu hiện khác biệt, bao gồm 82 protein được điều chỉnh tăng và 62 protein được điều chỉnh giảm ( Hình bổ sung S3B ). Sau đó, phân tích làm giàu chức năng GO chỉ ra rằng các protein được biểu hiện khác biệt liên quan đến nhiều chức năng sinh học, bao gồm các quá trình trao đổi chất ( Hình bổ sung S3C ). Bên cạnh đó, bằng cách sử dụng chú thích cụm nhóm trực hệ (COG), các protein được biểu hiện khác biệt có thể được chia thành ba loại chức năng khác nhau liên quan đến quá trình trao đổi chất, quá trình và tín hiệu tế bào, lưu trữ và xử lý thông tin, chiếm lần lượt 24,6, 19,3 và 43,0% ( Hình bổ sung S3D ).
Đối với hồ sơ chuyển hóa, các mẫu tế bào từ hai nhóm có thể được phân biệt tốt bằng PCA và OSPL-DA ( Hình bổ sung S3E, F ). Nhìn chung, dựa trên các tiêu chí sàng lọc với VIP ≥1, thay đổi gấp ≥ 2 và giá trị p ( p < 0,05 ), chúng tôi đã xác định được 33 chất chuyển hóa thay đổi đáng kể (28 tăng và 5 giảm) thuộc 9 loại, bao gồm glycerophospholipid, axit amin, axit cacboxylic, hợp chất vòng dị vòng, coenzyme và vitamin, v.v. ( Hình bổ sung S3G ). Đáng chú ý, gia vị glycerophospholipid là chất chuyển hóa chiếm đa số, chiếm 54,5%. Kết quả của nghiên cứu về proteomics và metabolomics không nhắm mục tiêu cho thấy chiết xuất bồ công anh phát huy tác dụng chống khối u của nó đối với TNBC bằng cách chủ yếu can thiệp vào các quá trình chuyển hóa lipid, đặc biệt là trong quá trình chuyển hóa glycerophospholipid.
Hồ sơ lipidome của MDA-MB-231 sau khi xử lý chiết xuất bồ công anh đã tiết lộ các quá trình điều hòa chuyển hóa chính của nó
Để giải quyết thêm các cơ chế điều hòa lipid của chiết xuất bồ công anh trên TNBC, lipidomic không nhắm mục tiêu đã được thực hiện bằng cách sử dụng tế bào TNBC, mô khối u và mẫu huyết tương để tìm ra các chất chuyển hóa lipid thay đổi đáng kể hơn và các con đường chuyển hóa liên quan của chúng. Xử lý mẫu tế bào MDA-MB-231 phù hợp với proteomics và metabolomics không nhắm mục tiêu, và các mẫu mô khối u và huyết tương được lấy từ mô hình chuột. PCA và OSPL-DA không giám sát chỉ ra rằng tất cả các mẫu từ hai nhóm đều tách biệt đáng kể ( Hình bổ sung S4–S6 ). Các chất chuyển hóa lipid thay đổi đáng kể đã được xác định bằng tiêu chí sàng lọc với VIP ≥1 và giá trị p ( p < 0,05 ). Cuối cùng, chúng tôi đã thu được 1.331 chất chuyển hóa lipid thay đổi đáng kể (26 tăng và 105 giảm) trong lipidomics tế bào có thể được phân loại thành glycerophospholipid, sphingolipid, cholesterol và axit béo không bão hòa ( Hình 4A ). Các lipid bị phá vỡ chủ yếu là glycerophospholipid, bao gồm phosphatidylcholine (PC), phosphatidylethanolamine (PE), lysophosphatidylcholine (LPC), alkyl phosphatidylcholine, alkyl phosphatidylethanolamine và lysophosphatidylethanolamine (LPE). Tổng lượng tương đối của từng loài lipid được hình dung trong Hình4B . Cụ thể, hàm lượng PC, PE, alkyl phosphatidylcholine, alkyl phosphatidylethanolamine, triglyceride (TG), sphingomyelin (SM) và ceramide (Cer) giảm đáng kể sau khi xử lý bằng chiết xuất bồ công anh. Ngược lại, tổng mức tương đối của LPC, LPE, cholesteryl ester (CE), axit linoleic (LA), axit oleic (OA) và axit margaroleic tăng lên.
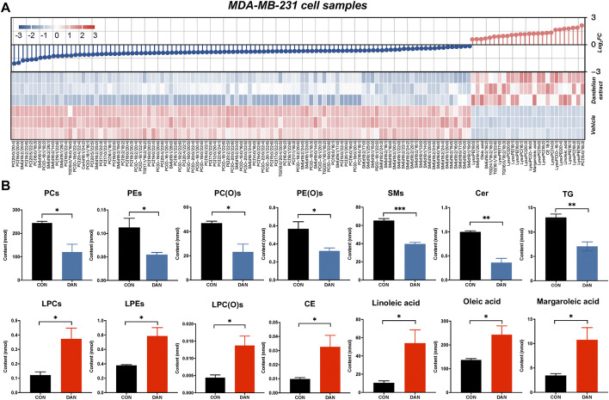
Hồ sơ lipidomics của tế bào MDA-MB-231 sau khi điều trị bằng chiết xuất bồ công anh. (A) Bản đồ nhiệt và biểu đồ thay đổi quả tạ của các chất chuyển hóa thay đổi đáng kể của lipidomics không được nhắm mục tiêu. (B) Các thay đổi của các chất chuyển hóa khác biệt đáng kể của lipidomics không được nhắm mục tiêu.
Hơn nữa, tổng cộng 16 chất chuyển hóa lipid đã thay đổi đáng kể trong lipidomics mô khối u (12 tăng và 4 giảm). PC, SM, Cer và axit docosatrienoic giảm và LPC tăng trong mô khối u ( Hình 5A ). Đáng chú ý, xu hướng biến đổi của PC, LPC, SM và Cer trong mô khối u phù hợp với lipidomics tế bào, cho thấy chiết xuất bồ công anh đã can thiệp vào quá trình tổng hợp phospholipid và sphingolipid của TNBC cả trong ống nghiệm và trong cơ thể sống . Bên cạnh đó, tổng cộng 10 chất chuyển hóa lipid thay đổi đáng kể đã được xác định bằng lipidomics huyết tương (8 tăng và 2 giảm) ( Hình 5B ). Các chất chuyển hóa sphingolipid như SM và Cer, PE và các axit béo không bão hòa như axit myristoleic và axit myristic đã tăng trong huyết tương. LPC và axit nervonic đã giảm trong huyết tương. Ngoài ra, sự làm giàu con đường KEGG chỉ ra quá trình chuyển hóa glycerophospholipid, chuyển hóa sphingolipid và chuyển hóa axit béo không bão hòa là những quá trình điều hòa chính ( Hình bổ sung S7 ).
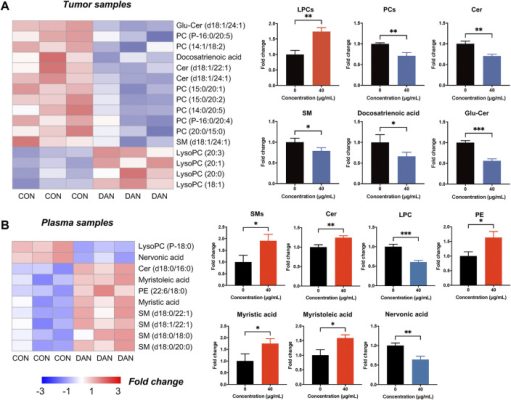
Hồ sơ lipidomics của mô khối u TNBC và huyết tương sau khi điều trị bằng chiết xuất bồ công anh. (A) Biểu đồ nhiệt độ của các chất chuyển hóa thay đổi đáng kể trong lipidomics mô khối u. (B) Biểu đồ nhiệt độ của các chất chuyển hóa thay đổi đáng kể trong lipidomics huyết tương.
Phân tích tích hợp xác định các con đường chuyển hóa chính và các dấu hiệu sinh học trong việc điều chỉnh chiết xuất bồ công anh trên TNBC
Sau đó, chúng tôi đã thực hiện một phân tích tích hợp dựa trên kết quả của dược lý học mạng và đa ô-mi để tìm ra các con đường chuyển hóa lipid được điều hòa đồng thời và xác định các quá trình điều hòa chính và các dấu ấn sinh học trong quá trình điều hòa chiết xuất bồ công anh chống lại TNBC. Như thể hiện trong Hình 6 , các con đường được điều hòa đồng thời bao gồm chuyển hóa axit linoleic (map02591), chuyển hóa glycerophospholipid (map00564), sinh tổng hợp axit béo không bão hòa (map01040), chuyển hóa axit alpha-linolenic (map00592) và chuyển hóa sphingolipid (map00600). Bằng cách khớp các protein liên quan đến chuyển hóa đã thay đổi được xác định trong nghiên cứu về protein, chúng tôi thấy rằng choline kinase α (CHKA) và FADS2 có mối liên hệ chặt chẽ với các chất chuyển hóa trong quá trình chuyển hóa glycerophospholipid và quá trình sinh tổng hợp axit béo không bão hòa. Trong quá trình chuyển hóa glycerophospholipid, biểu hiện CHKA bị giảm và mức độ các chất chuyển hóa hạ lưu của nó là PCho, PC và PE đồng thời giảm ( Hình 6A ). Bên cạnh đó, mức độ hàm lượng SM và Cer cũng giảm. Đáng chú ý, cả SM và PC đều là thành phần quan trọng của màng tế bào và tỷ lệ PC/SM có thể phản ánh tính lưu động của màng tế bào, có liên quan chặt chẽ đến khả năng xâm lấn và di cư của tế bào khối u. Kết quả của chúng tôi cho thấy tỷ lệ PC/SM giảm ở cả tế bào và mô TNBC ( Hình 6B ) và chứng minh rằng chiết xuất bồ công anh có thể cản trở sự hình thành màng tế bào và làm giảm tính lưu động của màng tế bào thông qua việc phá vỡ quá trình tổng hợp PC và SM, cuối cùng dẫn đến ức chế sự phát triển và di cư của tế bào TNBC.
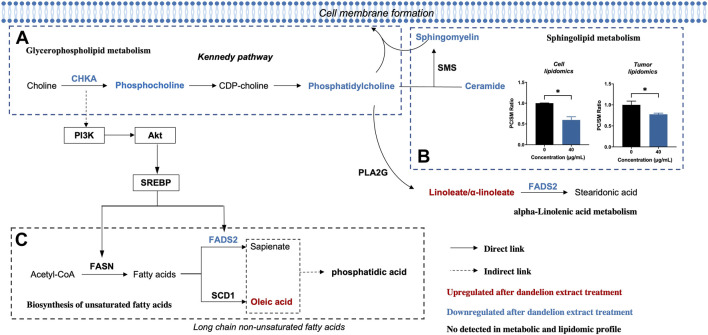
Các con đường chuyển hóa thay đổi của tế bào MDA-MB-231 sau khi xử lý chiết xuất bồ công anh. (A) Chuyển hóa Glycerophospholipid. (B) Chuyển hóa Sphingolipid. (C) Quá trình tổng hợp sinh học các axit béo không bão hòa.
Chiết xuất bồ công anh phá vỡ các con đường liên quan đến trao đổi chất trong ống nghiệm
Để chứng minh thêm độ chính xác của kết quả phân tích tích hợp, chúng tôi đã thực hiện xác nhận thực nghiệm trên các dấu ấn sinh học đã xác định là CHKA và FADS2, cũng như các con đường điều hòa liên quan của chúng. Đầu tiên, chúng tôi so sánh mức độ biểu hiện mRNA dựa trên hồ sơ phiên mã với 130 mẫu ung thư vú (41 TNBC và 89 ER + BC) và 11 mẫu mô vú bình thường ( bộ dữ liệu GSE65194 từ cơ sở dữ liệu Gene Expression Omnibus). Những dữ liệu này chỉ ra rằng mức độ biểu hiện mRNA của CHKA , FADS2 và SREBF1 cao hơn trong các mẫu ung thư vú so với mô vú bình thường và mức độ của chúng trong TNBC đã thay đổi đáng kể so với các mẫu ung thư vú ER + ( Hình 7A ). Sau đó, kết quả qRT-PCR xác nhận rằng mức độ mRNA của CHKA và FADS2 cao hơn trong các tế bào TNBC so với MCF-10A, nhưng không có sự khác biệt đáng kể nào về mức độ mRNA của SREBF1 ( Hình 7B ). Sau khi điều trị bằng chiết xuất bồ công anh, mức độ biểu hiện mRNA của CHKA, FADS2 và SREBF1 trong MDA-MB-231 đều giảm ( Hình 7C ). Đối với tế bào MCF-10A, chiết xuất bồ công anh chỉ làm giảm mức mRNA của FADS2 nhưng không có tác dụng đáng kể nào đối với CHKA và SREBF1 ( Hình 7D ) .
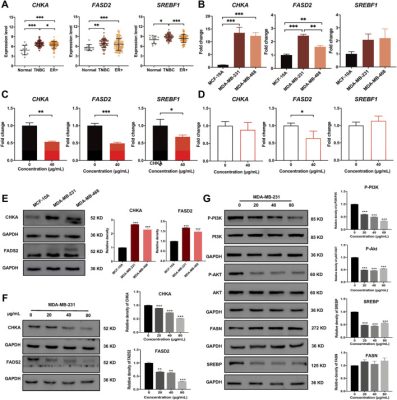
Chiết xuất bồ công anh ức chế mức độ biểu hiện mRNA và protein của các protein và con đường liên quan đến chuyển hóa. (A) Mức độ biểu hiện mRNA của CHKA, FADS2 và SREBF1 trong các mô ung thư vú bình thường, TNBC và ER + dựa trên tập dữ liệu GSE65194 . (B) Mức độ biểu hiện mRNA của CHKA, FADS2 và SREBF1 trong các tế bào TNBC và bình thường bằng RT-PCR. (C) Mức độ biểu hiện mRNA của CHKA, FADS2 và SREBF1 sau khi xử lý chiết xuất bồ công anh trong các tế bào MDA-MB-231 bằng RT-PCR. (D) Mức độ biểu hiện mRNA của CHKA, FADS2 và SREBF1 sau khi xử lý chiết xuất bồ công anh trong các tế bào MCF-10A bằng RT-PCR. (E) Mức độ biểu hiện protein của CHKA và FADS2 trong các tế bào MCF-10A và TNBC. (F) Mức độ biểu hiện protein của CHKA và FADS2 trong các tế bào MDA-MB-231 sau khi xử lý chiết xuất bồ công anh. (G) Mức độ biểu hiện của p-PI3K, p-AKT, SREBP và FASN trong tế bào MDA-MB-231 sau khi xử lý chiết xuất bồ công anh. *p < 0,05, **p < 0,01, ***p < 0,00 1.
Sau đó, kết quả phân tích Western blot cho thấy mức độ biểu hiện của CHKA và FADS2 trong tế bào TNBC cao hơn so với MCF-10A ( Hình 7E ). Sau khi điều trị bằng chiết xuất bồ công anh, mức độ biểu hiện của CHKA và FADS2 giảm theo liều lượng trong tế bào TNBC ( Hình 7F ). Hơn nữa, mức độ phosphoryl hóa của PI3K và AKT cũng giảm, cho thấy con đường PI3K/AKT bị chiết xuất bồ công anh ức chế ( Hình 7G ). Và biểu hiện của SREBP, mục tiêu hạ lưu của con đường PI3K/AKT, cũng giảm theo. Người ta chứng minh rằng FASN và FADS2 là mục tiêu của SREBP, lần lượt chiếm quá trình tổng hợp và khử bão hòa axit béo. Tuy nhiên, kết quả của chúng tôi cho thấy chiết xuất bồ công anh có thể ức chế biểu hiện của SREBP và FADS2, nhưng không có tác dụng ức chế rõ ràng đối với FASN ( Hình 7G ). Các kết quả trên khẳng định rằng chiết xuất bồ công anh có thể làm giảm mức độ biểu hiện mRNA và protein của CHKA và FADS2 và ức chế con đường PI3K/AKT trong tế bào TNBC.
Hơn nữa, kết quả trước đây của chúng tôi cho thấy rằng hàm lượng PCho giảm do chiết xuất bồ công anh ức chế CHKA. Có báo cáo rằng PCho, chất chuyển hóa trực tiếp của CHKA, tăng cao bất thường trong nhiều loại ung thư khác nhau và có thể cung cấp các phân tử phosphate để kích hoạt AKT, do đó thúc đẩy sự phát triển khối u. Để khám phá sự tương tác giữa CHKA và con đường truyền tín hiệu PI3K/ATK, các tế bào MDA-MB-231 đã được chuyển gen với siRNA CHKA. Kết quả xét nghiệm Western blot cho thấy biểu hiện CHKA trong các tế bào MDA-MB-231 bị ức chế đáng kể bởi siRNA CHKA, và mức độ phosphoryl hóa của PI3K và AKT cũng giảm tương tự sau khi ức chế nội sinh biểu hiện CHKA ( Hình 8A ). Ngược lại, việc bổ sung Cho và PCho ngoại sinh có thể đảo ngược mức độ phosphoryl hóa AKT giảm trong các tế bào MDA-MB-231 bằng chiết xuất bồ công anh ( Hình 8B ). Các kết quả trên cho thấy chiết xuất bồ công anh có thể ức chế con đường truyền tín hiệu PI3K/AKT bằng cách giảm biểu hiện CHKA và giảm tổng hợp Cho thành PCho, do đó làm giảm mức độ phosphoryl hóa của AKT.
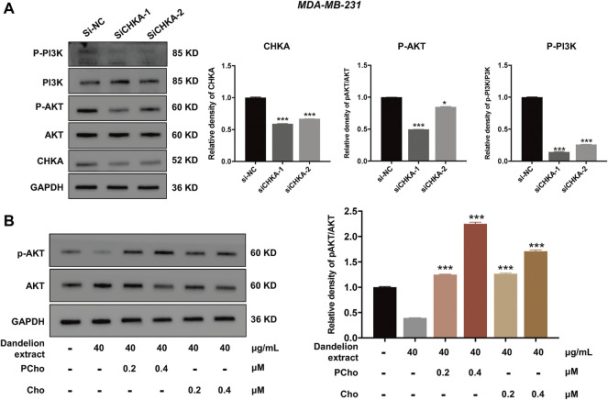
Chiết xuất bồ công anh ức chế mức độ biểu hiện mRNA và protein của các protein và con đường liên quan đến chuyển hóa. (A) Ức chế biểu hiện CHKA làm giảm mức độ phosphoryl hóa của PI3K và AKT. *p < 0,05, **p < 0,01, ***p < 0,00 1 so với si-NC. (B) Việc bổ sung Cho và PCho ngoại sinh đã đảo ngược mức độ phosphoryl hóa giảm của AKT trong tế bào MDA-MB-231. *p < 0,05, **p < 0,01, ***p < 0,00 1 so với chiết xuất bồ công anh (40 μg/kg).
Luteolin có thể là hợp chất hoạt tính sinh học chính trong chiết xuất bồ công anh thông qua việc ức chế CHKA
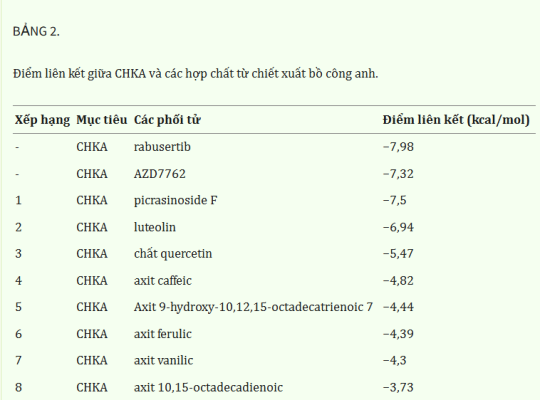
Phân tích tích hợp và xác nhận thực nghiệm cho thấy CHKA đóng vai trò quan trọng trong việc ức chế chiết xuất bồ công anh trên TNBC. Và phân tích dược lý mạng đã suy đoán tám hợp chất cần thiết cho tác dụng dược lý đa dạng của bồ công anh. Để giải quyết vấn đề liệu các hợp chất có thể tương tác trực tiếp với CHKA hay không, mô phỏng ghép nối phân tử đã được thực hiện để tính toán điểm liên kết giữa CHKA và các hợp chất. Điểm liên kết của CHKA và chất ức chế đặc hiệu của nó là rabusertib hoặc AZD7762 là đường cơ sở. Cấu trúc phân tử của các hợp chất được lấy từ cơ sở dữ liệu PubChem. Cấu trúc tinh thể 3D của CHKA và phức hợp hemicholinium-3 (mã PDB: 3F2R) được lấy từ PDB. Đáng chú ý, hemicholinium-3 phải được loại bỏ khỏi phức hợp bằng PyMOL và chỉ còn lại cấu trúc tinh thể 3D tinh khiết của CHKA. Ghép nối phân tử được xử lý thông qua AutoDock Vina và kết quả được xem và phân tích bằng PyMOL. Kết quả cho thấy tám hợp chất biểu hiện khả năng liên kết không nhất quán với CHKA ( Bảng 2 và Hình 9A ), và picrasinoside F, luteolin và esculetin sở hữu khả năng liên kết mạnh nhất với CHKA. Sau đó, chúng tôi đã thực hiện các xét nghiệm MTT sử dụng luteolin trên các tế bào TNBC và nó cho thấy tác dụng ức chế mạnh đối với các tế bào MDA-MB-231 ( Hình 9B ). Kết quả Western blot chứng minh rằng luteolin có thể làm giảm mức độ biểu hiện của CHKA, SREBP và p-AKT, phù hợp với xu hướng sau khi điều trị bằng chiết xuất bồ công anh ( Hình 9C ), cho thấy nó có thể là chất ức chế CHKA mới và là hợp chất hoạt tính sinh học chính trong chiết xuất bồ công anh.
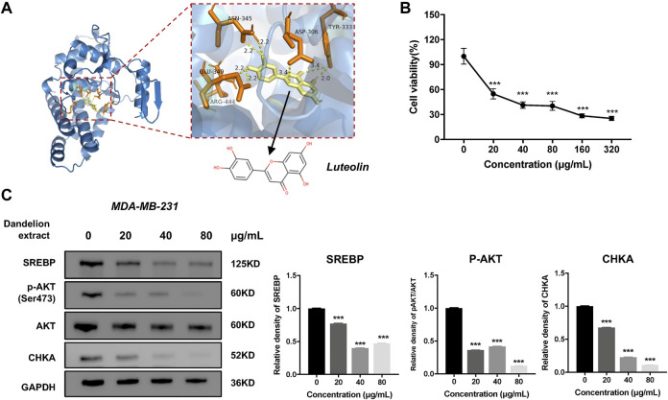
Luteolin có thể ức chế sự tăng sinh tế bào TNBC và làm giảm mức độ biểu hiện của CHKA. (A) Sự tương tác của cấu trúc tinh thể tiềm ẩn của miền CHKA trong phức hợp với luteolin dựa trên mô phỏng ghép nối phân tử. Đường chấm giữa hợp chất và protein chỉ liên kết hydro. TYR, tyrosine; CLU, axit glutamic; SER, serine; LEU, leucine; ASN, Asparagine; ASP, Axit aspartic; ARG, Arginine. (B) . Luteolin ức chế sự tăng sinh tế bào MDA-MB-231 bằng xét nghiệm MTT. (C) . Luteolin làm giảm mức độ biểu hiện của SREBP, CHKA và p-AKT. *p < 0,05, **p < 0,01, ***p < 0,00 1 so với 0 μg/ml.
Phần kết luận
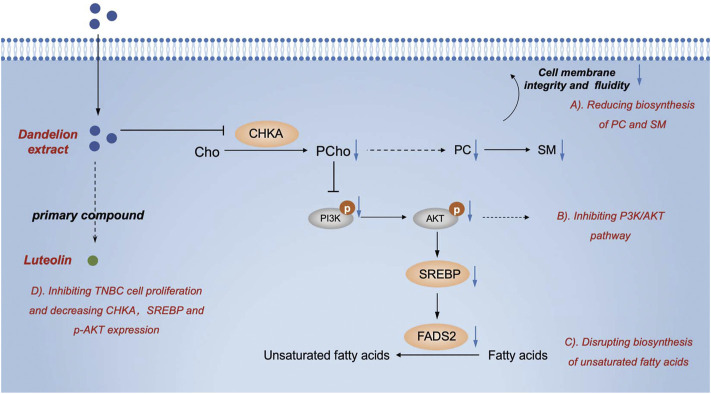
Tóm lại, chúng tôi đã xác nhận tác dụng chống khối u của chiết xuất bồ công anh trên TNBC trong ống nghiệm và thấy rằng chiết xuất bồ công anh có thể ức chế sự phát triển của khối u trong mô hình ghép dị chủ MDA-MB-231 và mô hình 4T1. Chúng tôi cũng đã trình bày các đặc điểm về protein và lipid của tế bào TNBC, mô khối u và huyết tương sau khi điều trị bằng chiết xuất bồ công anh. Thông qua phân tích tích hợp và vô hiệu hóa thử nghiệm trong ống nghiệm . Chúng tôi đã chứng minh rằng chiết xuất bồ công anh có thể can thiệp vào quá trình chuyển hóa glycerophospholipid và axit béo không bão hòa bằng cách ức chế trục CHKA/PI3K/AKT/FADS2, cuối cùng dẫn đến tắc nghẽn quá trình hình thành màng tế bào và chết tế bào khối u ( Hình 10 ). Ngoài ra, chúng tôi suy đoán rằng picrasinoside F và luteolin là các thành phần hoạt tính sinh học chính trong chiết xuất bồ công anh và có thể phát huy tác dụng dược lý của chúng chống lại TNBC thông qua liên kết CHKA trong silicon .
(Nguồn: Dịch từ Pubmed)
https://pmc.ncbi.nlm.nih.gov/articles/PMC9486077/#B26

